Современная PRP: «Клиническая PRP»
За последние 10 лет схема лечения PRP претерпела большие изменения.Благодаря экспериментальным и клиническим исследованиям мы теперь лучше понимаем физиологию тромбоцитов и других клеток.Кроме того, несколько высококачественных систематических оценок, метаанализов и рандомизированных контролируемых исследований показали эффективность биотехнологии PRP во многих областях медицины, включая дерматологию, кардиохирургию, пластическую хирургию, ортопедическую хирургию, обезболивание, заболевания позвоночника и спортивную медицину. .
Текущей характеристикой PRP является ее абсолютная концентрация тромбоцитов, которая изменяется от первоначального определения PRP (включая концентрацию тромбоцитов выше исходного значения) до более чем 1 × 10 6/мкл или примерно в 5 раз превышающей минимальную концентрацию тромбоцитов в тромбоцитах от базовый уровень.В обширном обзоре Fadadu et al.Было оценено 33 системы и протокола PRP.Количество тромбоцитов в конечном препарате PRP, вырабатываемом некоторыми из этих систем, ниже, чем в цельной крови.Они сообщили, что тромбоцитарный фактор PRP увеличился всего на 0,52 при использовании набора для однократного вращения (Selphyl ®).Напротив, EmCyte Genesis PurePRPII ® с двойным вращением. Концентрация тромбоцитов, создаваемая устройством, является самой высокой (1,6 × 10 6 /мкл).
Очевидно, что методы in vitro и на животных не являются идеальной исследовательской средой для успешного внедрения в клиническую практику.Аналогичным образом, исследование по сравнению устройств не поддерживает это решение, поскольку они показывают, что концентрация тромбоцитов между устройствами PRP сильно различается.К счастью, с помощью технологий и анализа, основанных на протеомике, мы можем улучшить наше понимание функций клеток в PRP, которые влияют на результаты лечения.Прежде чем достичь консенсуса по стандартизированным препаратам и составам PRP, PRP должна соответствовать клиническим составам PRP, чтобы способствовать существенным механизмам восстановления тканей и прогрессивным клиническим результатам.
Клиническая формула PRP
В настоящее время эффективная клиническая PRP (C-PRP) охарактеризована как сложная композиция аутологичных многоклеточных компонентов в небольшом объеме плазмы, полученной из части периферической крови после центрифугирования.После центрифугирования PRP и его нетромбоцитарно-клеточные компоненты могут быть извлечены из устройства для концентрирования в соответствии с разной плотностью клеток (из которых плотность тромбоцитов является самой низкой).
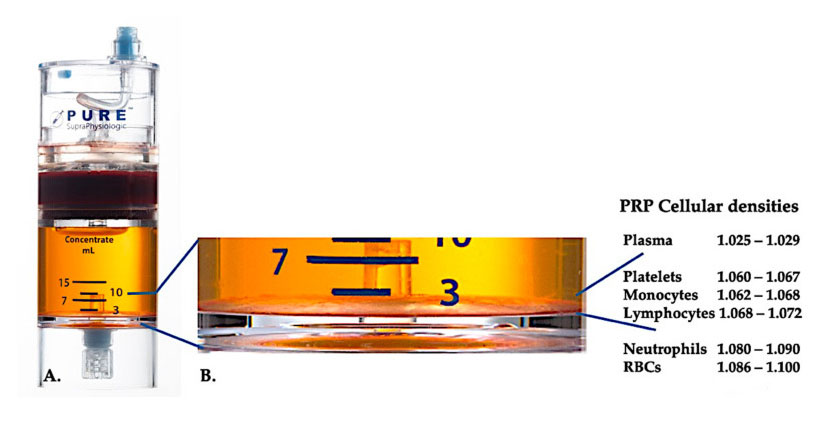
Использование Оборудование для разделения плотности клеток PurePRP-SP ® (EmCyte Corporation, Форт-Майерс, Флорида, США) использовалось для цельной крови после двух процедур центрифугирования.После первого процесса центрифугирования компонент цельной крови был разделен на два основных слоя: суспензию тромбоцитов (тощая) плазмы и слой эритроцитов.В A второй этап центрифугирования завершен.Фактический объем PRP может быть извлечен для использования пациентом.Увеличение на рисунке B показывает, что в нижней части оборудования организован многокомпонентный коричневый слой оседания эритроцитов (представлен синей линией), который содержит высокие концентрации тромбоцитов, моноцитов и лимфоцитов, исходя из градиента плотности.В этом примере согласно протоколу приготовления C-PRP с плохими нейтрофилами будет извлечен минимальный процент нейтрофилов (<0,3%) и эритроцитов (<0,1%).
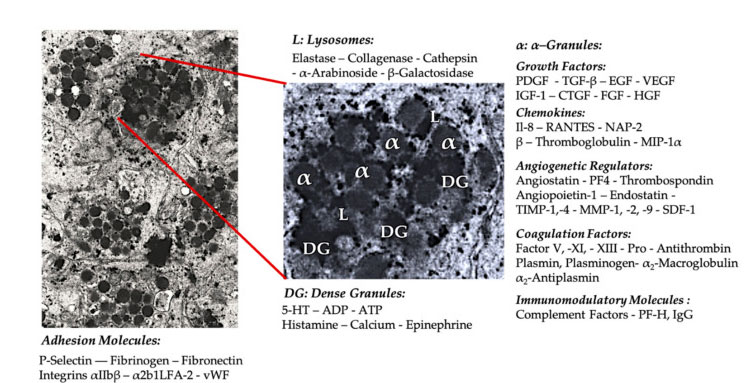
Тромбоцитарная гранула
При раннем клиническом применении PRP α-гранулы являются наиболее часто упоминаемой внутренней структурой тромбоцитов, поскольку они содержат факторы свертывания крови, большое количество PDGF и ангиогенных регуляторов, но обладают незначительной тромбогенной функцией.Другие факторы включают менее известные компоненты хемокинов и цитокинов, такие как фактор тромбоцитов 4 (PF4), основной претромбоцитарный белок, P-селектин (активатор интегрина) и хемокин RANTES (регулируемый путем активации, экспрессирующий нормальные Т-клетки и предположительно секретирующий).Общая функция этих специфических компонентов гранул тромбоцитов заключается в привлечении и активации других иммунных клеток или индукции воспаления эндотелиальных клеток.
Плотные гранулярные компоненты, такие как АДФ, серотонин, полифосфат, гистамин и адреналин, более неявно используются в качестве регуляторов активации тромбоцитов и тромбоза.Самое главное, что многие из этих элементов выполняют функцию модификации иммунных клеток.АДФ тромбоцитов распознается рецептором P2Y12ADP на дендритных клетках (ДК), тем самым увеличивая эндоцитоз антигена.DC (антигенпредставляющая клетка) очень важна для инициации Т-клеточного иммунного ответа и контроля защитного иммунного ответа, который связывает врожденную иммунную систему и адаптивную иммунную систему.Кроме того, аденозинтрифосфат тромбоцитов (АТФ) посылает сигналы через Т-клеточный рецептор P2X7, что приводит к усилению дифференцировки Т-хелперных клеток CD4 в провоспалительные Т-хелперные клетки 17 (Th17).Другие компоненты плотных гранул тромбоцитов (такие как глутамат и серотонин) индуцируют миграцию Т-клеток и увеличивают дифференцировку моноцитов в ДК соответственно.В PRP эти иммуномодуляторы, полученные из плотных частиц, сильно обогащены и обладают существенными иммунными функциями.
Число прямых и непрямых потенциальных взаимодействий между тромбоцитами и другими (рецепторными) клетками обширно.Следовательно, применение PRP в локальной патологической тканевой среде может вызывать различные воспалительные эффекты.
Концентрация тромбоцитов
C-PRP должен содержать клинические дозы концентрированных тромбоцитов для достижения благоприятного терапевтического эффекта.Тромбоциты в составе C-PRP должны стимулировать пролиферацию клеток, синтез мезенхимальных и нейротрофических факторов, способствовать миграции хемотаксических клеток и стимулировать иммунорегуляторную активность, как показано на рисунке.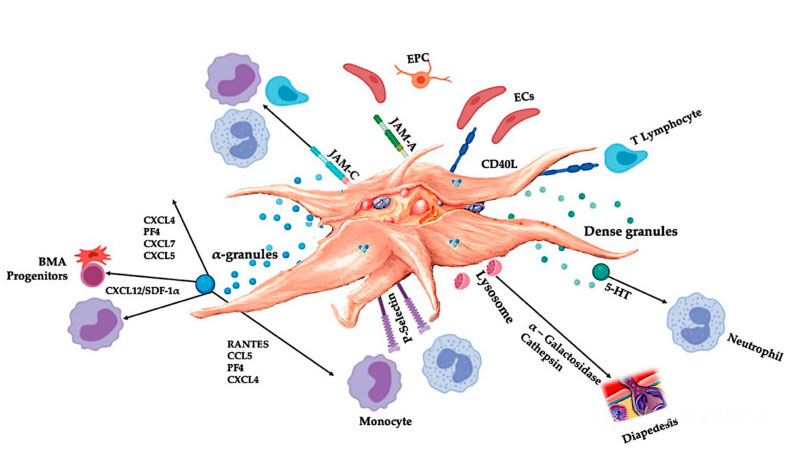
Активированные тромбоциты, высвобождение PGF и молекул адгезии опосредуют различные клеточные взаимодействия: хемотаксис, клеточную адгезию, миграцию и дифференцировку клеток, а также регулируют иммунорегуляторную активность.Эти межклеточные взаимодействия тромбоцитов способствуют ангиогенезу и воспалительной активности и, в конечном итоге, стимулируют процесс восстановления тканей.Сокращения: BMA: аспират костного мозга, EPC: эндотелиальные клетки-предшественники, EC: эндотелиальные клетки, 5-HT: 5-гидрокситриптамин, RANTES: активированная регуляция нормальной экспрессии Т-клеток и предполагаемой секреции, JAM: тип молекулы адгезии соединения, CD40L: кластер 40 лиганд, SDF-1 α: фактор-1 α, полученный из стромальных клеток, CXCL: лиганд хемокина (мотив CXC), PF4: фактор тромбоцитов 4. Адаптировано из Everts et al.
Маркс был первым, кто доказал, что заживление костей и мягких тканей ускорялось, а минимальное количество тромбоцитов составляло 1 × 10 6 /мкл. Эти результаты были подтверждены при исследовании поясничного спондилодеза через межпозвонковое отверстие, когда доза тромбоцитов превышала 1,3 × При 106 тромбоцитов/мкл это исследование продемонстрировало большее слияние.Кроме того, Джусти и др.Выявлено 1,5 × Механизм восстановления тканей при дозе 109 требует, чтобы тромбоциты/мл индуцировали функциональный ангиогенез посредством активности эндотелиальных клеток.В последнем исследовании более высокие концентрации снижали потенциал ангиогенеза тромбоцитов в фолликулах и вокруг них.Кроме того, более ранние данные показали, что доза PRP также будет влиять на результаты лечения.Следовательно, чтобы значительно индуцировать реакцию ангиогенеза и стимулировать пролиферацию и миграцию клеток, C-PRP должен содержать не менее 7,5 C-PRP в бутылке для лечения PRP объемом 5 мл × 10 9 могут доставлять тромбоциты.
Помимо зависимости от дозы, влияние PRP на активность клеток, по-видимому, сильно зависит от времени.Софи и др.Эти результаты позволяют предположить, что кратковременное воздействие лизатов тромбоцитов человека может стимулировать пролиферацию костных клеток и хемотаксис.Напротив, длительное воздействие PRP приведет к снижению уровня щелочной фосфатазы и минералообразования.
Красная кровяная клетка
Эритроциты отвечают за транспортировку кислорода к тканям и перенос углекислого газа из тканей в легкие.Они не имеют ядра и состоят из молекул гема, которые связываются с белками.Компоненты железа и гема в эритроцитах способствуют соединению кислорода и углекислого газа.Как правило, жизненный цикл эритроцитов составляет около 120 дней.Они удаляются из кровообращения макрофагами в результате процесса, называемого старением эритроцитов.Эритроциты в образцах PRP могут быть повреждены в условиях сдвига (например, в результате операции по кровотечению из цельной крови, иммуноопосредованного процесса, окислительного стресса или неадекватной схемы концентрации PRP).Следовательно, клеточная мембрана эритроцитов разлагается и высвобождает токсичный гемоглобин (Hb), измеряемый по свободному гемоглобину плазмы (PFH), гему и железу.].ПФГ и продукты его деградации (гем и железо) совместно приводят к вредному и цитотоксическому воздействию на ткани, приводя к окислительному стрессу, потере оксида азота, активации воспалительных путей и иммуносупрессии.Эти эффекты в конечном итоге приведут к дисфункции микроциркуляции, местной вазоконстрикции и повреждению сосудов, а также к серьезному повреждению тканей.
Самое главное, что когда эритроциты, содержащие C-PRP, доставляются в ткани, это вызывает местную реакцию, называемую эриптозом, которая запускает высвобождение эффективного ингибитора миграции цитокинов и макрофагов.Этот цитокин ингибирует миграцию моноцитов и макрофагов.Он оказывает сильные провоспалительные сигналы на окружающие ткани, ингибирует миграцию стволовых клеток и пролиферацию фибробластов и приводит к значительной локальной клеточной дисфункции.Поэтому важно ограничить загрязнение эритроцитами препаратов PRP.Кроме того, роль эритроцитов в регенерации тканей никогда не была определена.Адекватное центрифугирование и подготовка C-PRP обычно уменьшают или даже устраняют присутствие эритроцитов, избегая таким образом неблагоприятных последствий гемолиза и полицитемии.
Лейкоциты в C-PRP
Наличие лейкоцитов в препаратах PRP зависит от оборудования для лечения и схемы приготовления.В оборудовании PRP на основе плазмы лейкоциты полностью удаляются;Однако лейкоциты были значительно сконцентрированы в препарате PRP коричневого слоя оседания эритроцитов.Благодаря своим иммунным и защитным механизмам, лейкоциты сильно влияют на внутреннюю биологию острых и хронических состояний тканей.Эти особенности будут обсуждаться далее.Следовательно, присутствие специфических лейкоцитов в C-PRP может вызывать значительные клеточные и тканевые эффекты.Более конкретно, в различных системах коричнево-желтого слоя седиментации эритроцитов PRP используются разные схемы подготовки, что приводит к получению разной пропорции нейтрофилов, лимфоцитов и моноцитов в PRP.Эозинофилы и базофилы невозможно измерить в препаратах PRP, поскольку их клеточные мембраны слишком хрупкие, чтобы выдерживать центробежные силы обработки.
Нейтрофилы
Нейтрофилы являются важными лейкоцитами во многих путях заживления.Эти пути в сочетании с антимикробными белками, присутствующими в тромбоцитах, образуют плотный барьер против инвазивных патогенов.Существование нейтрофилов определяется в соответствии с целью лечения C-PRP.Повышенный уровень воспаления тканей может потребоваться при биотерапии PRP для ухода за хроническими ранами или в приложениях, направленных на рост или заживление костей.Важно отметить, что в нескольких моделях были обнаружены дополнительные функции нейтрофилов, что подчеркивает их роль в ангиогенезе и восстановлении тканей.Однако нейтрофилы также могут оказывать вредное воздействие, поэтому для некоторых применений они непригодны.Чжоу и Ван доказали, что использование PRP, богатого нейтрофилами, может привести к увеличению соотношения коллагена III типа к коллагену I типа, что усугубляет фиброз и снижает прочность сухожилий.Другими вредными характеристиками, опосредованными нейтрофилами, являются высвобождение воспалительных цитокинов и матриксных металлопротеиназ (ММП), которые могут способствовать воспалению и катаболизму при нанесении на ткани.
Лейкомоноцит
В C-PRP мононуклеарные Т- и В-лимфоциты более сконцентрированы, чем любые другие лейкоциты.Они тесно связаны с клеточно-опосредованным цитотоксическим адаптивным иммунитетом.Лимфоциты могут запускать клеточные реакции для борьбы с инфекцией и адаптации к захватчикам.Кроме того, цитокины, производные Т-лимфоцитов (интерферон-γ [IFN-γ] и интерлейкин-4 (IL-4), усиливают поляризацию макрофагов. Верассар и др. Доказано, что обычные Т-лимфоциты могут косвенно способствовать заживлению тканей при на мышиной модели путем регуляции дифференцировки моноцитов и макрофагов.
Моноциты – мультипотентные репаративные клетки.
В зависимости от используемого устройства для приготовления PRP моноциты могут выступать или отсутствовать в бутылке для лечения PRP.К сожалению, их работоспособность и способность к регенерации редко обсуждаются в литературе.Поэтому моноцитам в способе приготовления или окончательной формуле уделяется мало внимания.Группа моноцитов гетерогенна, происходит из клеток-предшественников костного мозга и транспортируется в периферические ткани через путь гемопоэтических стволовых клеток в соответствии со стимуляцией микроокружения.Во время гомеостаза и воспаления циркулирующие моноциты покидают кровоток и рекрутируются в поврежденные или деградированные ткани.Они могут действовать как макрофаги (M Φ), эффекторные клетки или клетки-предшественники.Моноциты, макрофаги и дендритные клетки представляют собой мононуклеарную фагоцитарную систему (МПС). Типичной особенностью МПС является пластичность структуры экспрессии генов и функциональное перекрытие между этими типами клеток.В дегенерированных тканях резидентные макрофаги, локально действующие факторы роста, провоспалительные цитокины, апоптотические или некротические клетки и микробные продукты инициируют дифференцировку моноцитов в группы клеток MPS.Предположим, что когда C-PRP, содержащий высокопродуктивные моноциты, вводится в локальное микроокружение заболевания, моноциты, вероятно, дифференцируются в M Φ, вызывая серьезные клеточные изменения.
От моноцита к М Ф В процессе трансформации специфический Фенотип М Ф.В последние десять лет была разработана модель, объединяющая M Φ. Сложный механизм активации описывается как поляризация двух противоположных состояний: M Φ Фенотип 1 (M Φ 1, Классическая активация) и M Φ Фенотип 2 (M Φ 2, альтернативная активация).М Φ 1 характеризуется секрецией воспалительных цитокинов (IFN-γ) и оксида азота, обеспечивающих эффективный механизм уничтожения патогенов.M Φ Фенотип также продуцирует фактор роста эндотелия сосудов (VEGF) и фактор роста фибробластов (FGF).M Φ Фенотип состоит из противовоспалительных клеток с высоким фагоцитозом.M Φ 2 Продуцируют компоненты внеклеточного матрикса, ангиогенез и хемокины, а также интерлейкин 10 (IL-10).Помимо защиты от патогенов, M Φ также может уменьшать воспаление и способствовать восстановлению тканей.Примечательно, что М Ф 2 подразделяется на М in vitro Ф 2а, М Ф 2b и М Ф 2. Это зависит от стимула.Трансляция этих подтипов in vivo затруднена, поскольку ткань может содержать смешанные группы M Φ.Интересно, что, основываясь на местных сигналах окружающей среды и уровнях IL-4, провоспалительный M Φ 1 может быть преобразован в стимулирование восстановления M Φ 2. На основании этих данных разумно предположить, что существуют высокие концентрации моноцитов и препаратов M Φ C-PRP. могут способствовать лучшему восстановлению тканей, поскольку они обладают противовоспалительным действием на восстановление тканей и способностью передавать клеточные сигналы.
Запутанное определение фракции лейкоцитов в PRP.
Наличие лейкоцитов в флаконах для лечения PRP зависит от устройства для приготовления PRP и может иметь существенные различия.Существует много споров о существовании лейкоцитов и их вкладе в различные продукты суб-PRP (такие как PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF и L-PRF). В недавнем обзоре шесть рандомизированных контролируемые исследования (уровень доказательности 1) и три проспективных сравнительных исследования (уровень доказательности 2) включали 1055 пациентов, что указывает на одинаковую безопасность LR-PRP и LP-PRP.Автор пришел к выводу, что побочная реакция PRP не может быть напрямую связана с концентрацией лейкоцитов.В другом исследовании LR-PRP не изменил воспалительный интерлейкин (IL-1) при ОА коленного сустава (β、 IL-6, IL-8 и IL-17).Эти результаты подтверждают мнение о том, что роль лейкоцитов в биологической активности PRP in vivo может быть обусловлена перекрестными помехами между тромбоцитами и лейкоцитами.Это взаимодействие может способствовать биосинтезу других факторов (таких как липоксиген), которые могут компенсировать или способствовать регрессу воспаления.После первоначального высвобождения воспалительных молекул (арахидоновой кислоты, лейкотриена и простагландина) из активированных тромбоцитов высвобождается липоксиген А4, чтобы предотвратить активацию нейтрофилов.Именно в этой среде фенотип M Φ из M Φ 1 переключается на M Φ 2. Кроме того, появляется все больше доказательств того, что циркулирующие мононуклеарные клетки могут дифференцироваться во множество типов нефагоцитарных клеток благодаря своей плюрипотентности.
Тип PRP будет влиять на культуру MSC.По сравнению с чистыми образцами PRP или PPP, LR-PRP может индуцировать значительно более высокую пролиферацию МСК, полученных из костного мозга (BMMSC), с более быстрым высвобождением и лучшей биологической активностью PGF.Все эти характеристики способствуют добавлению моноцитов в бутылку для лечения PRP и выявлению их иммуномодулирующей способности и потенциала дифференцировки.
Врожденная и адаптивная иммунная регуляция PRP
Самая известная физиологическая функция тромбоцитов – остановка кровотечения.Они накапливаются в месте повреждения тканей и поврежденных кровеносных сосудах.Эти события вызваны экспрессией интегринов и селектинов, которые стимулируют адгезию и агрегацию тромбоцитов.Поврежденный эндотелий еще больше усугубляет этот процесс, а обнаженный коллаген и другие белки субэндотелиального матрикса способствуют глубокой активации тромбоцитов.В этих случаях доказана важная роль взаимодействия фактора фон Виллебранда (vWF) и гликопротеина (GP), особенно GP-Ib.После активации тромбоцитов α-、 Плотные тромбоциты, лизосомы и Т-гранулы регулируют экзоцитоз и высвобождают свое содержимое во внеклеточную среду.
Молекула адгезии тромбоцитов
Чтобы лучше понять роль PRP в воспалительных тканях и тромбоцитах в иммунном ответе, мы должны понять, как различные поверхностные рецепторы тромбоцитов (интегрины), молекулы адгезии соединений (JAM) и клеточные взаимодействия могут инициировать критические процессы врожденного и адаптивного иммунитета.
Интегрины представляют собой молекулы адгезии на клеточной поверхности, обнаруженные в различных типах клеток и экспрессируемые в больших количествах на тромбоцитах.Интегрины включают a5b1, a6b1, a2b1 LFA-2 (GPIa/IIa) и aIIbb3 (GPIIb/IIIa).Обычно они существуют в статическом состоянии с низкой аффинностью.После активации они переходят в состояние высокой аффинности связывания лиганда.Интегрины выполняют различные функции на тромбоцитах и участвуют во взаимодействии тромбоцитов с несколькими типами лейкоцитов, эндотелиальными клетками и внеклеточным матриксом.Кроме того, комплекс GP-Ib-V-IX экспрессируется на мембране тромбоцитов и является основным рецептором связывания с фон vWF.Это взаимодействие опосредует первоначальный контакт между тромбоцитами и обнаженными субэндотелиальными структурами.Тромбоцитарный интегрин и комплекс ГП связаны с различными воспалительными процессами и играют важную роль в формировании тромбоцитарно-лейкоцитарного комплекса.В частности, интегрин aIIbb3 необходим для образования стабильного комплекса путем объединения фибриногена с рецептором антигена макрофага 1 (Mac-1) на нейтрофилах.
Тромбоциты, нейтрофилы и эндотелиальные клетки сосудов экспрессируют специфические молекулы клеточной адгезии, называемые селектинами.При воспалительных состояниях тромбоциты экспрессируют P-селектин и нейтрофильный L-селектин.После активации тромбоцитов P-селектин может связываться с лигандом PSGL-1, который существует на нейтрофилах и моноцитах.Кроме того, связывание PSGL-1 инициирует внутриклеточную сигнальную каскадную реакцию, которая активирует нейтрофилы посредством нейтрофильного интегрина Mac-1 и антигена 1, связанного с функцией лимфоцитов (LFA-1).Активированный Mac-1 связывается с GPIb или GPIIb/IIIa на тромбоцитах через фибриноген, стабилизируя тем самым взаимодействие между нейтрофилами и тромбоцитами.Кроме того, активированный LFA-1 может объединяться с молекулой межклеточной адгезии тромбоцитов 2 для дальнейшей стабилизации комплекса нейтрофил-тромбоциты и содействия долгосрочной адгезии с клетками.
Тромбоциты и лейкоциты играют ключевую роль во врожденных и адаптивных иммунных реакциях.
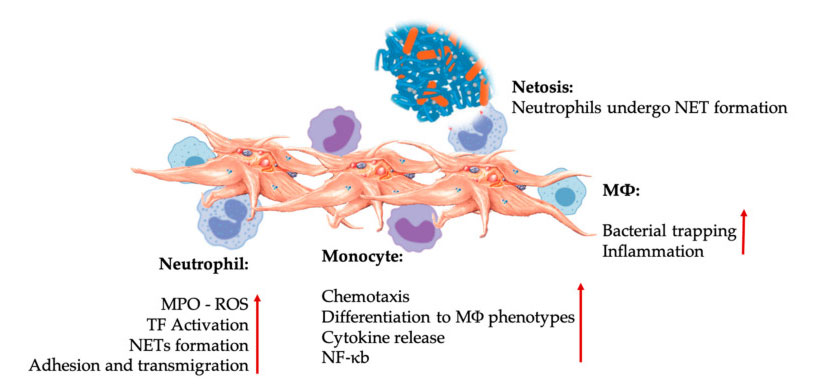
Организм может распознавать инородные тела и поврежденные ткани при острых или хронических заболеваниях, чтобы инициировать каскадную реакцию заживления ран и воспалительный путь.Врожденная и адаптивная иммунные системы защищают хозяина от инфекции, а лейкоциты играют важную роль в перекрытии между двумя системами.В частности, моноциты, макрофаги, нейтрофилы и естественные клетки-киллеры играют ключевую роль во врожденной системе, тогда как лимфоциты и их подмножества играют аналогичную роль в адаптивной иммунной системе.
Взаимодействие тромбоцитов и лейкоцитов при взаимодействии клеток врожденного иммунитета.Тромбоциты взаимодействуют с нейтрофилами и моноцитами и, наконец, с М Ф взаимодействуют, корректируют и усиливают их эффекторные функции.Эти взаимодействия тромбоцитов и лейкоцитов приводят к воспалению посредством различных механизмов, включая НЕТоз.Сокращения: MPO: миелопероксидаза, ROS: активные формы кислорода, TF: тканевой фактор, NET: внеклеточная ловушка нейтрофилов, NF- κ B: ядерный фактор каппа B, M Φ: Макрофаги.
Врожденная иммунная система
Роль врожденной иммунной системы заключается в неспецифической идентификации инвазивных микроорганизмов или фрагментов тканей и стимулировании их выведения.Когда определенные молекулярные структуры, называемые рецепторами распознавания образов поверхностной экспрессии (PRR), сочетаются с молекулярными паттернами, связанными с патогенами, и молекулярными паттернами, связанными с повреждениями, активируется врожденная иммунная система.Существует много видов PRR, включая Toll-подобный рецептор (TLR) и RIG-1-подобный рецептор (RLR).Эти рецепторы могут активировать основной транскрипционный фактор каппа B (NF-κ B). Он также регулирует множество аспектов врожденного и адаптивного иммунного ответа.Интересно, что тромбоциты также экспрессируют на своей поверхности и цитоплазме различные молекулы иммунорегуляторных рецепторов, такие как P-селектин, трансмембранный белок CD40-лиганд (CD40L), цитокины (такие как IL-1β, TGF-β) и специфичный для тромбоцитов TLR. Следовательно, тромбоциты могут взаимодействовать с различными иммунными клетками.
Взаимодействие тромбоцитов и лейкоцитов при врожденном иммунитете
Когда тромбоциты попадают в кровоток или ткани или проникают в них, тромбоциты являются одними из клеток, которые первыми обнаруживают повреждение эндотелия и микробные патогены.Агрегация тромбоцитов способствует высвобождению агонистов тромбоцитов АДФ, тромбина и фактора Виллебранда, что приводит к активации тромбоцитов и экспрессии хемокиновых рецепторов тромбоцитов C, CC, CXC и CX3C, вызывая тем самым тромбоциты в инфицированном участке или повреждении.
Врожденная иммунная система генетически предопределена обнаруживать захватчиков, таких как вирусы, бактерии, паразиты и токсины, или тканевые раны и раны.Это неспецифическая система, поскольку любой патоген будет идентифицирован как чужеродный или чужой и быстро обнаружен.Врожденная иммунная система опирается на набор белков и фагоцитов, которые распознают хорошо сохранившиеся характеристики патогенов и быстро активируют иммунный ответ, помогая уничтожить захватчиков, даже если хозяин никогда раньше не подвергался воздействию конкретных патогенов.
Нейтрофилы, моноциты и дендритные клетки являются наиболее распространенными клетками врожденного иммунитета в крови.Их привлечение необходимо для адекватного раннего иммунного ответа.Когда PRP используется в регенеративной медицине, взаимодействие тромбоцитов и лейкоцитов регулирует воспаление, заживление ран и восстановление тканей.TLR-4 на тромбоцитах стимулирует взаимодействие тромбоцитов и нейтрофилов, которое регулирует так называемый окислительный взрыв лейкоцитов путем регулирования высвобождения активных форм кислорода (АФК) и миелопероксидазы (МПО) из нейтрофилов.Кроме того, взаимодействие тромбоцитов-нейтрофилов и дегрануляции нейтрофилов приводит к образованию нейтрофильно-внеклеточных ловушек (НЭТ).Сети состоят из ядра нейтрофилов и другого внутриклеточного содержимого нейтрофилов, которое может захватывать бактерии и убивать их посредством НЕТоза.Образование сетей является важным механизмом уничтожения нейтрофилов.
После активации тромбоцитов моноциты могут мигрировать в больные и дегенеративные ткани, где они осуществляют адгезионную активность и секретируют воспалительные молекулы, которые могут изменить хемотаксис и протеолитические свойства.Кроме того, тромбоциты могут индуцировать активацию моноцитов NF-κ B для регулирования эффекторной функции моноцитов, которая является ключевым медиатором воспалительного ответа, а также активации и дифференцировки иммунных клеток.Тромбоциты дополнительно способствуют эндогенному окислительному взрыву моноцитов, способствуя уничтожению фагоцитарных патогенов.Высвобождение МПО опосредовано прямым взаимодействием тромбоцитов-моноцитов CD40L-MAC-1.Интересно, что когда P-селектин активирует тромбоциты при острых и хронических воспалительных состояниях тканей, хемокины тромбоцитарного происхождения PF4, RANTES, IL-1β и CXCL-12 могут предотвращать спонтанный апоптоз моноцитов, но способствуют их дифференцировке в макрофаги.
Адаптивная иммунная система
После того, как неспецифическая врожденная иммунная система распознает микробное или тканевое повреждение, специфическая адаптивная иммунная система возьмет на себя управление.Адаптивные системы включают антигенсвязывающие В-лимфоциты (В-клетки) и обычные Т-лимфоциты (Treg), которые координируют выведение патогенов.Т-клетки можно условно разделить на Т-хелперы (Th-клетки) и цитотоксические Т-клетки (Тс-клетки, также известные как Т-киллеры).Th-клетки далее делятся на клетки Th1, Th2 и Th17, которые выполняют ключевые функции при воспалении.Th-клетки могут секретировать провоспалительные цитокины (например, IFN-γ、 TNF-β) и некоторые интерлейкины (например, IL-17). Они особенно эффективны в предотвращении внутриклеточной вирусной и бактериальной инфекции. Th-клетки стимулируют пролиферацию и дифференцировку клеток, участвующих в иммунный ответ.Тс-клетки являются эффекторными клетками, которые могут уничтожать целевые внутриклеточные и внеклеточные микроорганизмы и клетки.
Интересно, что клетки Th2 продуцируют IL-4 и влияют на M Φ поляризацию, M Φ Направляемую регенерацию M Φ 2 фенотип, тогда как IFN- γ M Φ меняется на воспалительный фенотип M Φ 1, который зависит от дозы и времени действия цитокинов.После активации IL-4 M Φ 2 индуцирует дифференцировку Treg-клеток в клетки Th2, а затем продуцирует дополнительный IL-4 (петля положительной обратной связи).Th-клетки конвертируют М Ф Фенотип направлен на регенеративный фенотип в ответ на биологические агенты тканевого происхождения.Этот механизм основан на доказательствах того, что Th-клетки играют значительную роль в контроле воспаления и восстановлении тканей.
Взаимодействие тромбоцитов и лейкоцитов при адаптивном иммунитете
Адаптивная иммунная система использует антигенспецифические рецепторы, запоминает ранее встреченные патогены и уничтожает их при последующей встрече с хозяином.Однако эти адаптивные иммунные реакции развивались медленно.Кониас и др.Это показывает, что тромбоцитарный компонент способствует восприятию риска и восстановлению тканей, а взаимодействие между тромбоцитами и лейкоцитами способствует активации адаптивного иммунного ответа.
Во время адаптивного иммунного ответа тромбоциты стимулируют реакцию моноцитов и макрофагов посредством созревания DC и NK-клеток, что приводит к специфическим ответам Т- и В-клеток.Таким образом, компоненты гранул тромбоцитов напрямую влияют на адаптивный иммунитет, экспрессируя CD40L, молекулу, которая необходима для регуляции адаптивного иммунного ответа.Тромбоциты через CD40L не только играют роль в презентации антигена, но также влияют на реакцию Т-клеток.Лю и др.Было обнаружено, что тромбоциты сложным образом регулируют ответ CD4 Т-клеток.Эта дифференциальная регуляция субпопуляций Т-клеток CD4 означает, что тромбоциты стимулируют Т-клетки CD4 реагировать на воспалительные стимулы, вызывая тем самым сильные провоспалительные и противовоспалительные реакции.
Тромбоциты также регулируют опосредованный В-клетками адаптивный ответ на микробные патогены.Хорошо известно, что CD40L на активированных CD4 Т-клетках запускает CD40 В-клеток, обеспечивая второй сигнал, необходимый для Т-зависимой активации В-лимфоцитов, последующей конверсии аллотипа, а также дифференцировки и пролиферации В-клеток.В целом результаты ясно показывают различные функции тромбоцитов в адаптивном иммунитете, указывая на то, что тромбоциты связывают взаимодействие между Т-клетками и В-клетками через CD40-CD40L, тем самым усиливая Т-зависимый ответ В-клеток.Кроме того, тромбоциты богаты рецепторами на клеточной поверхности, которые могут способствовать активации тромбоцитов и высвобождать большое количество воспалительных и биологически активных молекул, хранящихся в различных частицах тромбоцитов, влияя тем самым на врожденный и адаптивный иммунный ответ.
Расширенная роль серотонина, полученного из тромбоцитов, в PRP
Серотонин (5-гидрокситриптамин, 5-НТ) играет очевидную ключевую роль в центральной нервной системе (ЦНС), включая толерантность к боли.Подсчитано, что большая часть человеческого 5-НТ вырабатывается в желудочно-кишечном тракте, а затем в кровотоке, где он поглощается тромбоцитами через транспортер обратного захвата серотонина и сохраняется в плотных частицах в высокой концентрации (65 ммоль/л).5-НТ — известный нейромедиатор и гормон, который помогает регулировать различные нейропсихологические процессы в ЦНС (центральный 5-НТ).Однако большая часть 5-НТ существует вне ЦНС (периферический 5-НТ) и участвует в регуляции системных и клеточных биологических функций многих систем органов, включая сердечно-сосудистую, легочную, желудочно-кишечную, мочеполовую и тромбоцитарную функциональные системы.5-HT имеет зависящий от концентрации метаболизм в различных типах клеток, включая адипоциты, эпителиальные клетки и лейкоциты.Периферический 5-HT также является мощным иммуномодулятором, который может стимулировать или подавлять воспаление и влиять на различные иммунные клетки через свой специфический рецептор 5-HT (5HTR).
Паракринный и аутокринный механизм ГТ.
Активность 5-HT опосредована его взаимодействием с 5HTR, которые представляют собой суперсемейство, состоящее из семи членов (5-HT 1–7) и по меньшей мере 14 различных подтипов рецепторов, включая недавно открытый член 5-HT 7, его периферические и функция в управлении болью.В процессе дегрануляции тромбоцитов активированные тромбоциты секретируют большое количество тромбоцитарного 5-HT, который может способствовать сокращению сосудов и стимулировать активацию соседних тромбоцитов и лимфоцитов посредством экспрессии 5-HTR на эндотелиальных клетках, гладкомышечных клетках и иммунные клетки.Пакала и др.Изучено митотическое действие 5-НТ на эндотелиальные клетки сосудов и определена возможность стимулирования роста поврежденных кровеносных сосудов за счет стимуляции ангиогенеза.Как регулируются эти процессы, не совсем ясно, но они могут включать в себя дифференциальные двусторонние сигнальные пути в тканевой микросхеме для регуляции функций сосудистых эндотелиальных клеток и гладкомышечных клеток, фибробластов и иммунных клеток через специфические 5-НТ-рецепторы на этих клетках. .Описана аутокринная функция тромбоцитов 5-НТ после активации тромбоцитов [ССЫЛКА].Высвобождение 5-НТ усиливает активацию тромбоцитов и рекрутирование циркулирующих тромбоцитов, что приводит к активации реакций сигнального каскада и вышестоящих эффекторов, поддерживающих реактивность тромбоцитов.
Иммуномодулирующий эффект 5-НТ
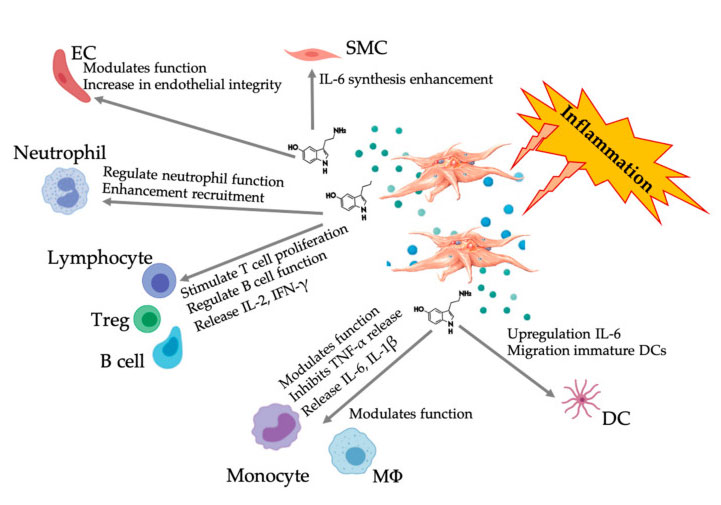
Все больше и больше данных показывают, что серотонин может играть роль в различных 5HTR в качестве иммуномодулятора.Согласно 5HTR, экспрессируемому в различных лейкоцитах, участвующих в воспалительной реакции, 5-HT, полученный из тромбоцитов, действует как иммунный регулятор как в врожденной, так и в адаптивной иммунной системе.5-HT может стимулировать пролиферацию Treg и регулировать функции B-клеток, естественных клеток-киллеров и нейтрофилов, привлекая DC и моноциты в очаг воспаления.Недавние исследования показали, что 5-HT, полученный из тромбоцитов, может регулировать функцию иммунных клеток в определенных условиях.Таким образом, использование C-PRP при концентрации тромбоцитов более 1 × 10 6/мкл может значительно способствовать транспортировке концентрации 5-HT, полученной из крупных тромбоцитов, в ткани.В микроокружении, характеризующемся воспалительными компонентами, PRP может взаимодействовать с несколькими иммунными клетками, играющими ключевую роль в этих патологиях, что может влиять на клинические результаты.
На рисунке показан многогранный ответ 5-HT после активации воспалительных тромбоцитов PRP.После активации тромбоцитов тромбоциты высвобождают свои гранулы, в том числе 5-НТ в плотных гранулах, который оказывает широкий спектр дифференциального воздействия на различные иммунные клетки, эндотелиальные клетки и гладкомышечные клетки.Сокращения: SMC: гладкомышечные клетки, EC: эндотелиальные клетки, Treg: обычные Т-лимфоциты, M Φ: макрофаги, DC: дендритные клетки, IL: интерлейкин, IFN-γ: интерферон γ. Модифицировано и адаптировано из Everts et al.и Халл и др.
Анальгетический эффект PRP
Активированные тромбоциты высвободят множество провоспалительных и противовоспалительных медиаторов, которые могут не только вызывать боль, но и уменьшать воспаление и боль.После применения типичная динамика тромбоцитов PRP меняет микроокружение перед восстановлением и регенерацией тканей посредством множества сложных путей, связанных с анаболизмом и катаболизмом, пролиферацией клеток, дифференцировкой и регуляцией стволовых клеток.Эти характеристики PRP приводят к применению PRP при различных клинических патологических состояниях, обычно связанных с хронической болью (таких как спортивные травмы, ортопедические заболевания, заболевания позвоночника и сложные хронические раны), хотя точный механизм полностью не определен.
В 2008 году Эвертц и др.Это первое рандомизированное контролируемое исследование, в котором сообщается об обезболивающем эффекте препарата PRP, который готовится из коричневого слоя оседания аутологичных эритроцитов и активируется аутологичным тромбином после операции на плече.Они отметили значительное снижение баллов по визуальной аналоговой шкале, использование анальгетиков на основе опиоидов и более успешную послеоперационную реабилитацию.Примечательно, что они отражают анальгезирующий эффект активированных тромбоцитов и предполагают механизм высвобождения тромбоцитами 5-НТ.Короче говоря, тромбоциты находятся в состоянии покоя в свежеприготовленной PRP.После активации тромбоцитов прямо или косвенно (тканевой фактор) тромбоциты меняют форму и образуют достаточно ложную форму, чтобы способствовать агрегации тромбоцитов.Затем они высвобождают внутриклеточные α-А плотные частицы.В ткань, обработанную активированной PRP, будут проникать PGF, цитокины и другие лизосомы тромбоцитов.Точнее, когда плотные частицы высвобождают свое содержимое, они выделяют большое количество 5-HT, который регулирует боль.При C-PRP концентрация тромбоцитов в 5–7 раз выше, чем в периферической крови.Следовательно, высвобождение 5-НТ из тромбоцитов является астрономическим.Интересно, что Спротт и др.В отчете отмечается, что боль значительно уменьшилась после иглоукалывания и прижигания, концентрация 5-HT, полученного тромбоцитами, значительно снизилась, а затем уровень 5-HT в плазме увеличился.
На периферии тромбоциты, тучные клетки и эндотелиальные клетки выделяют эндогенный 5-НТ во время повреждения тканей или хирургической травмы.Интересно, что в периферической области были обнаружены разнообразные 5-НТ-рецепторы нейронов, что подтвердило, что 5-НТ может вмешиваться в ноцицептивную передачу в периферической области.Эти исследования показывают, что 5-НТ может влиять на ноцицептивную передачу периферических тканей через рецепторы 5-НТ1, 5-НТ2, 5-НТ3, 5-НТ4 и 5-НТ7.
Система 5-HT представляет собой мощную систему, которая может уменьшать и увеличивать степень боли после вредной стимуляции.Сообщалось о центральной и периферической регуляции ноцицептивных сигналов и изменениях в системе 5-НТ у пациентов с хронической болью.В последние годы большое количество исследований было сосредоточено на роли 5-НТ и его соответствующих рецепторов в обработке и регулировании вредной информации, в результате чего были созданы такие лекарства, как селективные ингибиторы обратного захвата серотонина (СИОЗС).Этот препарат ингибирует обратный захват серотонина в пресинаптические нейроны после высвобождения серотонина.Он влияет на продолжительность и интенсивность передачи серотонина и является альтернативным методом лечения хронической боли.Необходимы дальнейшие клинические исследования, чтобы четко понять молекулярный механизм регуляции боли 5-НТ, вызываемой PRP, при хронических и дегенеративных заболеваниях.
Другие данные для определения потенциального обезболивающего эффекта PRP можно получить после испытания на модели обезболивающего на животных.Сравнительные статистические выводы в этих моделях сложны, поскольку эти исследования содержат слишком много переменных.Тем не менее, некоторые клинические исследования обращали внимание на ноцицептивные и обезболивающие эффекты PRP.Несколько исследований показали, что у пациентов, получающих лечение по поводу тендиноза или разрывов вращательной манжеты, боль практически не облегчается.Напротив, несколько других исследований показали, что PRP может уменьшить или даже устранить боль у пациентов с дегенерацией сухожилий, ОА, подошвенным фасциитом и другими заболеваниями стопы и голеностопного сустава.Конечная концентрация тромбоцитов и биологический клеточный состав были определены как ключевые характеристики PRP, которые помогают наблюдать устойчивый обезболивающий эффект после применения PRP.Другие переменные включают метод доставки PRP, технологию применения, протокол активации тромбоцитов, уровень биологической активности PGF и высвобождаемых цитокинов, тип ткани применения PRP и тип повреждения.
Примечательно, что Каффлер раскрыл потенциал PRP в облегчении боли у пациентов с хронической нейропатической болью от легкой до тяжелой степени, вторичной по отношению к поврежденному нерегенеративному нерву.Цель этого исследования — выяснить, можно ли уменьшить или ослабить нейропатическую боль благодаря PRP, способствующей регенерации аксонов и реиннервации целевых нервов.Удивительно, но среди пациентов, получающих лечение, нейропатическая боль все еще устраняется или облегчается по крайней мере через шесть лет после операции.Кроме того, у всех пациентов боли начали уменьшаться в течение трех недель после применения PRP.
Недавно аналогичные обезболивающие эффекты PRP наблюдались в области ухода за послеоперационными ранами и кожей.Интересно, что авторы сообщили о физиологических аспектах раневой боли, связанных с повреждением сосудов и гипоксией кожных тканей.Они также обсудили важность ангиогенеза в оптимизации оксигенации и доставки питательных веществ.Их исследование показало, что по сравнению с контрольной группой пациенты, получавшие лечение PRP, испытывали меньше боли и значительно увеличивали ангиогенез.Наконец, Джохал и его коллеги провели систематический обзор и метаанализ и пришли к выводу, что PRP может уменьшить боль после использования PRP по ортопедическим показаниям, особенно у пациентов, получающих лечение наружного эпикондилита и ОА коленного сустава.К сожалению, в этом исследовании не было указано влияние лейкоцитов, концентрации тромбоцитов или использования экзогенных активаторов тромбоцитов, поскольку эти переменные могут повлиять на общую эффективность PRP.Оптимальная концентрация тромбоцитов PRP для максимального облегчения боли неясна.В крысиной модели тендиноза концентрация тромбоцитов составляла 1,0×10 6 /мк. При L боль может быть полностью купирована, в то время как облегчение боли, вызванное PRP с половиной концентрации тромбоцитов, значительно снижается.Поэтому мы призываем проводить больше клинических исследований по изучению обезболивающего действия различных препаратов PRP.
PRP и эффект ангиогенеза
Препараты C-PRP в точной регенеративной медицине позволяют доставлять биомолекулы, высвобождаемые высокими концентрациями тромбоцитов, активированных в целевых участках ткани.Таким образом, были инициированы различные каскадные реакции, которые способствуют локальной иммунной регуляции, воспалительному процессу и ангиогенезу, способствуя заживлению и восстановлению тканей.
Ангиогенез представляет собой динамический многоэтапный процесс, включающий прорастание тканевых микрососудов из ранее существовавших кровеносных сосудов.Ангиогенез прогрессирует благодаря множеству биологических механизмов, включая миграцию, пролиферацию, дифференцировку и деление эндотелиальных клеток.Эти клеточные процессы являются предпосылками для образования новых кровеносных сосудов.Они необходимы для роста уже существующих кровеносных сосудов, восстановления кровотока и поддержания высокой метаболической активности восстановления и регенерации тканей.Эти новые кровеносные сосуды позволяют доставлять кислород и питательные вещества, а также удалять побочные продукты из обработанных тканей.
Активность ангиогенеза регулируется путем стимуляции ангиогенного фактора VEGF и антиангиогенных факторов (например, ангиостатина и тромбоспондина-1 [TSP-1]).В пораженной и деградированной микросреде (включая низкое напряжение кислорода, низкий уровень pH и высокий уровень молочной кислоты) местные ангиогенные факторы восстанавливают активность ангиогенеза.
Некоторые растворимые в тромбоцитах среды, такие как основной FGF, TGF-β и VEGF, могут стимулировать эндотелиальные клетки к образованию новых кровеносных сосудов.Ландсдаун и Фортье сообщили о различных результатах, связанных с составом PRP, включая внутритромбоцитарные источники многих ангиогенных регуляторов.Кроме того, они пришли к выводу, что усиление ангиогенеза способствует заживлению заболеваний MSK в областях с плохой васкуляризацией, таких как разрыв мениска, повреждение сухожилия и другие области с плохой васкуляризацией.
Стимулирование и антиангиогенные свойства тромбоцитов
Опубликованные за последние несколько десятилетий исследования доказали, что тромбоциты играют ключевую роль в первичном гемостазе, образовании тромбов, высвобождении факторов роста и цитокинов, а также регуляции ангиогенеза как части процесса восстановления тканей.Парадоксально, но гранулы PRP α-содержат арсенал проангиогенных факторов роста, антиангиогенных белков и цитокинов (таких как PF4, ингибитор активатора плазминогена-1 и TSP-1) и нацелены на высвобождение специфических факторов, которые играют роль .Роль в ангиогенезе.Следовательно, роль PRP в контроле регуляции ангиогенеза может определяться активацией специфических рецепторов клеточной поверхности, TGF-β, инициирующих проангиогенные и антиангиогенные реакции.Способность тромбоцитов осуществлять путь ангиогенеза была подтверждена при патологическом ангиогенезе и опухолевом ангиогенезе.
Тромбоцитарный ангиогенный фактор роста и антиангиогенный фактор роста, полученные из α-А и плотных и адгезивных молекул.Самое главное, общепринято, что общий эффект тромбоцитов на ангиогенез является проангиогенным и стимулирующим.Ожидается, что PRP-терапия будет контролировать индукцию ангиогенеза, что будет способствовать эффекту лечения многих заболеваний, таких как заживление ран и восстановление тканей.Введение PRP, а точнее введение высоких концентраций PGF и других цитокинов тромбоцитов, может индуцировать ангиогенез, ангиогенез и артериогенез, поскольку фактор 1a, происходящий из стромальных клеток, связывается с рецептором CXCR4 на эндотелиальных клетках-предшественниках.Билл и др.Предполагается, что PRP увеличивает ишемическую неоваскуляризацию, что может быть связано со стимуляцией ангиогенеза, ангиогенеза и артериогенеза.В их модели in vitro пролиферация эндотелиальных клеток и образование капилляров индуцировались большим количеством различных PDG, из которых VEGF был основным ангиогенным стимулятором.Другим важным и существенным фактором восстановления пути ангиогенеза является синергизм между несколькими PGF.Ричардсон и др.Доказано, что синергическая активность ангиогенного фактора тромбоцитарного фактора роста-bb (PDGF-BB) и VEGF приводит к быстрому формированию зрелой сосудистой сети по сравнению с активностью отдельного фактора роста.Совместное действие этих факторов недавно было подтверждено в исследовании по усилению коллатерального кровообращения головного мозга у мышей с длительной гипоперфузией.
Самое главное, что в исследовании in vitro измерялось пролиферативное влияние эндотелиальных клеток пупочной вены человека и различных концентраций тромбоцитов на выбор устройства для приготовления PRP и стратегии дозы тромбоцитов, и результаты показали, что оптимальная доза тромбоцитов составляла 1,5 × 10 6 тромбоцитов/мкм. 50. Способствовать ангиогенезу.Слишком высокая концентрация тромбоцитов может ингибировать процесс ангиогенеза, поэтому эффект будет плохим.
Старение клеток, старение и PRP
Старение клеток может быть вызвано различными стимулами.Это процесс, при котором клетки перестают делиться и претерпевают уникальные фенотипические изменения, предотвращающие неограниченный рост поврежденных клеток, что играет важную роль в профилактике рака.В процессе физиологического старения репликационное старение клеток также будет способствовать старению клеток, а регенерационная способность МСК будет снижаться.
Эффекты старения и старения клеток
In vivo многие типы клеток в процессе старения стареют и накапливаются в различных тканях, среди которых имеется большое количество стареющих клеток.Накопление стареющих клеток, по-видимому, увеличивается с возрастом, повреждением иммунной системы, повреждением тканей или факторами, связанными со стрессом.Механизм клеточного старения идентифицирован как патогенный фактор возрастных заболеваний, таких как остеоартрит, остеопороз и дегенерация межпозвоночных дисков.Различные раздражители усугубляют старение клеток.В ответ секреторный фенотип, связанный со старением (SASP), будет секретировать высокие концентрации белковых клеток и цитокинов.Этот особый фенотип связан со стареющими клетками, в которых они секретируют высокие уровни воспалительных цитокинов (таких как IL-1, IL-6, IL-8), факторов роста (таких как TGF-β、 HGF, VEGF, PDGF), ММП и катепсин.Доказано, что по сравнению с молодыми людьми SAPS увеличивается с возрастом, поскольку стационарный процесс разрушается, что приводит к старению клеток и снижению способности к регенерации.В частности, при заболеваниях суставов и скелетных мышц.В этом отношении иммунное старение считается значительным изменением в спектре секреции иммунных клеток, указывающим на то, что концентрация TNF-a, IL-6 и/или Il-1b увеличивается, что приводит к вялотекущему хроническому воспалению.Стоит отметить, что дисфункция стволовых клеток также связана с неклеточными автономными механизмами, такими как старение клеток, особенно с выработкой провоспалительных и антирегенеративных факторов посредством SASP.
Напротив, SASP может также стимулировать клеточную пластичность и перепрограммирование соседних клеток.Кроме того, SASP может организовывать связь с различными иммунными медиаторами и активировать иммунные клетки, способствуя удалению стареющих клеток.Понимание роли и функции стареющих клеток будет способствовать заживлению и ремоделированию тканей мышц MSK и хронических ран.
Примечательно, что Ritcka et al.Было проведено обширное исследование, и была обнаружена основная и полезная роль SASP в повышении пластичности клеток и регенерации тканей, а также была введена концепция временного лечения стареющих клеток.Они осторожно отметили, что старение – это преимущественно полезный и регенеративный процесс.
Старение клеток и потенциал PRP
Поскольку количество стволовых клеток уменьшается, старение влияет на производительность стволовых клеток.Аналогичным образом, у людей характеристики стволовых клеток (такие как сухость, пролиферация и дифференцировка) также уменьшаются с возрастом.Ван и Нирмала сообщили, что старение приведет к снижению характеристик стволовых клеток сухожильных клеток и количества рецепторов факторов роста.Исследование на животных показало, что концентрация PDGF у молодых лошадей была высокой.Они пришли к выводу, что увеличение количества рецепторов GF и количества GF у молодых людей может иметь лучший клеточный ответ на лечение PRP, чем у пожилых людей у молодых людей.Эти результаты показывают, почему лечение PRP может быть менее эффективным или даже неэффективным у пожилых пациентов с меньшим количеством стволовых клеток и «низким качеством».Доказано, что после инъекции PRP процесс старения хряща обращается вспять и период покоя хондроцитов увеличивается.Цзя и др.Он используется для изучения фотостарения дермы мышей in vitro с обработкой PRP и без нее, чтобы прояснить механизм противодействия PGF в этой модели.Группа PRP продемонстрировала прямое влияние на внеклеточный матрикс, увеличение коллагена I типа и снижение синтеза металлопротеиназ, что указывает на то, что PRP может противодействовать старению клеток, а также при дегенеративном заболевании MSK.
В другом исследовании PRP использовался для сбора старых стволовых клеток костного мозга у старых мышей.Было установлено, что PRP может восстанавливать различные функции стволовых клеток после старения, такие как пролиферация клеток и образование колоний, а также реконструировать маркеры, связанные со старением клеток.
Недавно Оберлор и его коллеги тщательно изучили роль старения клеток в ослаблении регенерации мышц и оценили PRP и плазму с низким содержанием тромбоцитов (PPP) как варианты биологического лечения для восстановления скелетных мышц.Они предполагали, что лечение PRP или PPP для восстановления скелетных мышц будет основано на биологических факторах, адаптированных к специфическим клеточным маркерам SASP и другим факторам, которые приводят к развитию фиброза.
Разумно полагать, что до применения PRP целенаправленное старение клеток может улучшить регенерационные характеристики эффективности биологической обработки за счет снижения местных факторов SASP.Было высказано предположение, что еще одним вариантом улучшения результатов лечения PRP и PPP для регенерации скелетных мышц является избирательное удаление стареющих клеток с помощью стареющих поглотителей.Нет сомнений в том, что недавние результаты исследований влияния PRP на старение и старение клеток увлекательны, но они все еще находятся на начальной стадии.Поэтому в настоящее время давать какие-либо предложения неразумно.
(Содержание этой статьи перепечатано, и мы не предоставляем каких-либо явных или подразумеваемых гарантий точности, достоверности или полноты содержания, содержащегося в этой статье, и не несем ответственности за мнения в этой статье, пожалуйста, поймите.)
Время публикации: 01 марта 2023 г.